
Onkologiekongresse
0
136
133
133
121
129
85
125
78
123
69
104
46
69
31
22
10
2
0
0
0
3
6
9
12
15
18
21
24
27
0
10
20
30
40
50
60
70
80
90
100
No. at Risk
Ibrutinib
Chlorambucil
Months
Progression-Fee Survival (%)
Chlorambucil
Chlorambucil
Ibrutinib
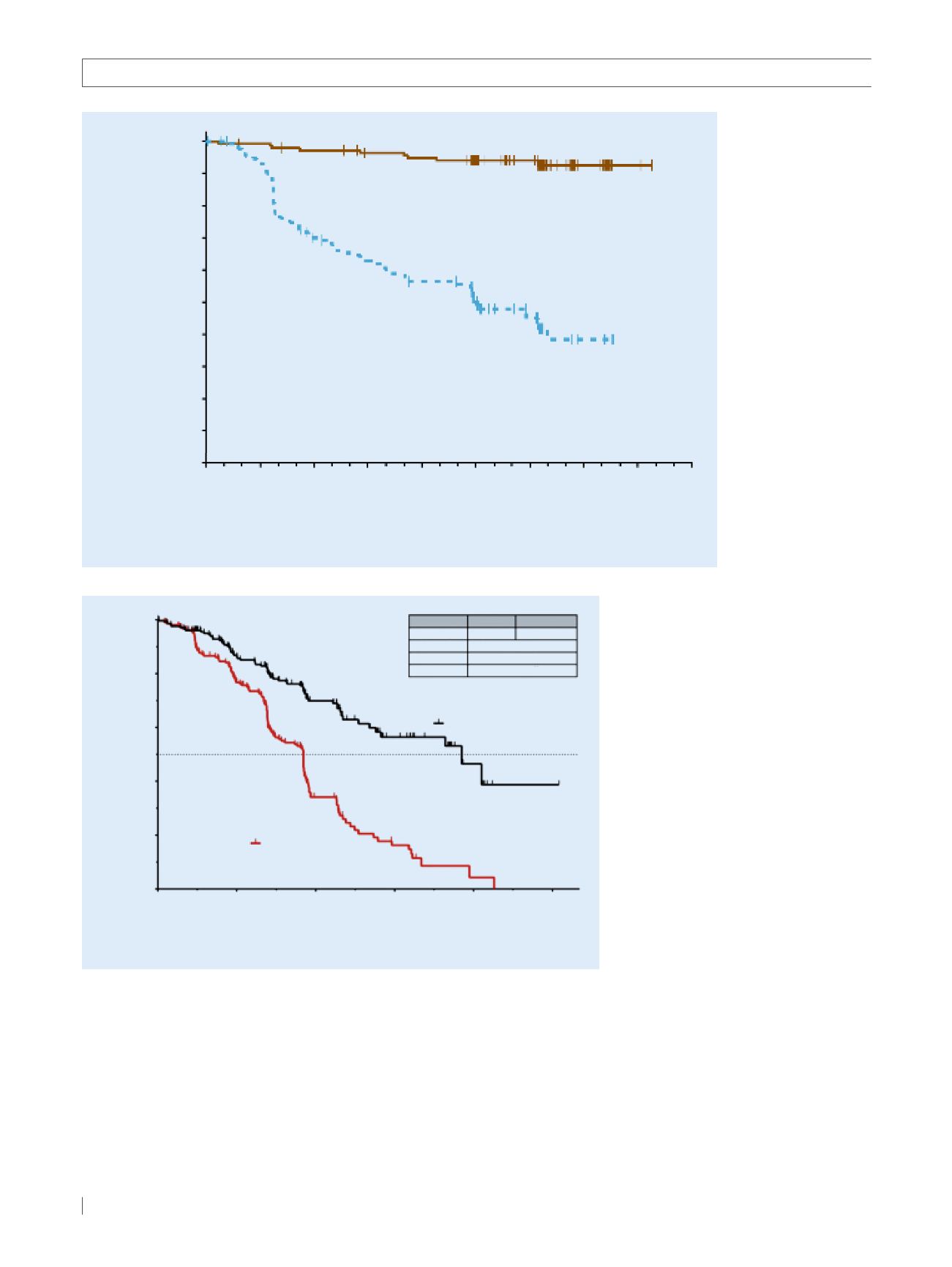
Median time [months]
15.0
NE
Hazard ratio, 0.09 (95% Cl, 0.04-0.17)
P < 0.001 by log-rank test
Ibrutinib
Abb. 2
9
Das progressi-
onsfreie Überleben war
für die Patienten im Ibruti-
nib-Arm signifikant länger
als für diejenigen im Chlo-
rambucil-Arm. (Nach
[ 8 ])
Time (months)
Probability of PFS
BR + Placebo
IDELA + BR
0
6
12
18
24
30
0
20
40
60
80
100
N at risk [Events]
IDELA+BR
BR-PLACEBO
207 [0]
209 [0]
154 [25]
145 [46]
74 [51]
36 [111]
27 [61]
11 [126]
6 [63]
1 [131]
1 [64]
0 [132]
IDELA + BR
BR + PLACEBO
Med. PFS ()
23.1
11.1
HR
99 % Cl
P value
0.33
0.24, 0.45
2.8 x 10
-14
Abb. 3
8
Das vomunabhängigen Review-Komitee ermittelte PFSwar in der Idelalisib-Gruppe signifi-
kant länger. (Nach
[ 9 ])
Idelalisib-„boosted“-Effekt von
Standardschema
Als Late-breaking-Abstract wurde eine
Studie präsentiert, in der eine zielgerich-
tete Therapie mit Idelalisib bei älteren
CLL-Patienten zu so deutlichen Ver-
besserungen der Überlebensergebnisse
führte, dass sie frühzeitig entblindet
wurde
[ 9 ]. Idelalisib ist der erste PI3k-δ-
Inhibitor und in Kombination mit Ritu-
ximab zur Behandlung von rezidivierter
CLL zugelassen, bei Risikopatienten
auch schon zur Erstlinientherapie. In
der placebokontrollierten randomisier-
tenPhase-3-Studie wurden 416 Patienten
mit Bendamustin und Rituximab (BR)
plus Placebo oder plus 2-mal täglich
Idelalisib behandelt. Primärer Endpunkt
war das progressionsfreie Überleben
(PFS), zu den sekundären Endpunkten
gehörte u. a. das Gesamtüberleben (OS).
Bei einer vorher geplanten Interimsana-
lyse betrug das PFS in der Idelalisib-
Gruppe 23 Monate im Vergleich zu nur
11 Monaten im BR-Arm (
.
Abb.
3 ).
Aufgrund dieser überdeutlichen Ergeb-
nisse empfahl das unabhängige Review-
Komitee, die Studie zu entblinden. Das
Sicherheitsprofil der BR-Idelalisib-Kom-
bination entsprach dem aus früheren
Studien. An Toxizität fielen besonders
Neutropenien und Anämien auf. Eine
Dosisreduktion erfolgte in 11 %, ein
Therapieabbruch in 26 % der Fälle, im
Vergleich zu 6 und 13 % unter BR.
Venetoclax durchbricht
Apoptosehemmung
Eine weitere Studie verzeichnete sogar
bei Patienten mit rezidivierter, refraktä-
rer CLL (R/R CLL) und prognostisch un-
günstiger 17p-Deletion mit einer zielge-
210
Der Onkologe 3 · 2016


















