von Übergewicht bestehe aber dennoch
die Herausforderung, alle Frauen darin
zu unterstützen, auf ihr Gewicht zu ach-
ten und Übergewicht zu reduzieren.
Bronchialkarzinom – Richtiges
Medikament zur richtigen
Zeit für geeignete Patienten
Neues zu EGFR-Mutationen
Der Science-Aspekt des diesjährigen
ASCO-Mottos schien bei den Fortschrit-
ten in der Forschung und den daraus re-
sultierenden Behandlungsoptionen bei
Lungenkrebs besonders gut mit Leben er-
füllt. „Right drug, right patient, right ti-
me“ war eine der Kernbotschaften aus
den Veranstaltungen zum metastasierten
nichtkleinzelligen Bronchialkarzinom.
EGFR-Mutationen zählen zu den
Dri-
ver-Mutationen
bei nichtkleinzelligen
Bronchialkarzinomen (NSCLC). Den
ersten beiden EGFR-Tyrosinkinaseinhi-
bitoren Erlotinib und Gefintinb folgte im
letzten Jahr Afatinibmit der Zulassung für
die Erstlinientherapie. Die Behandlung ist
bei aktivierender Mutation von EGFR in-
diziert. Eine gepoolte Analyse der beiden
Afatinib-Zulassungsstudien LUX-Lung 3
und Lux-Lung 6 zeigte nun, dass es sich
durchaus lohnt, bei den Patienten auch
die Subtypen der Mutationen zu bestim-
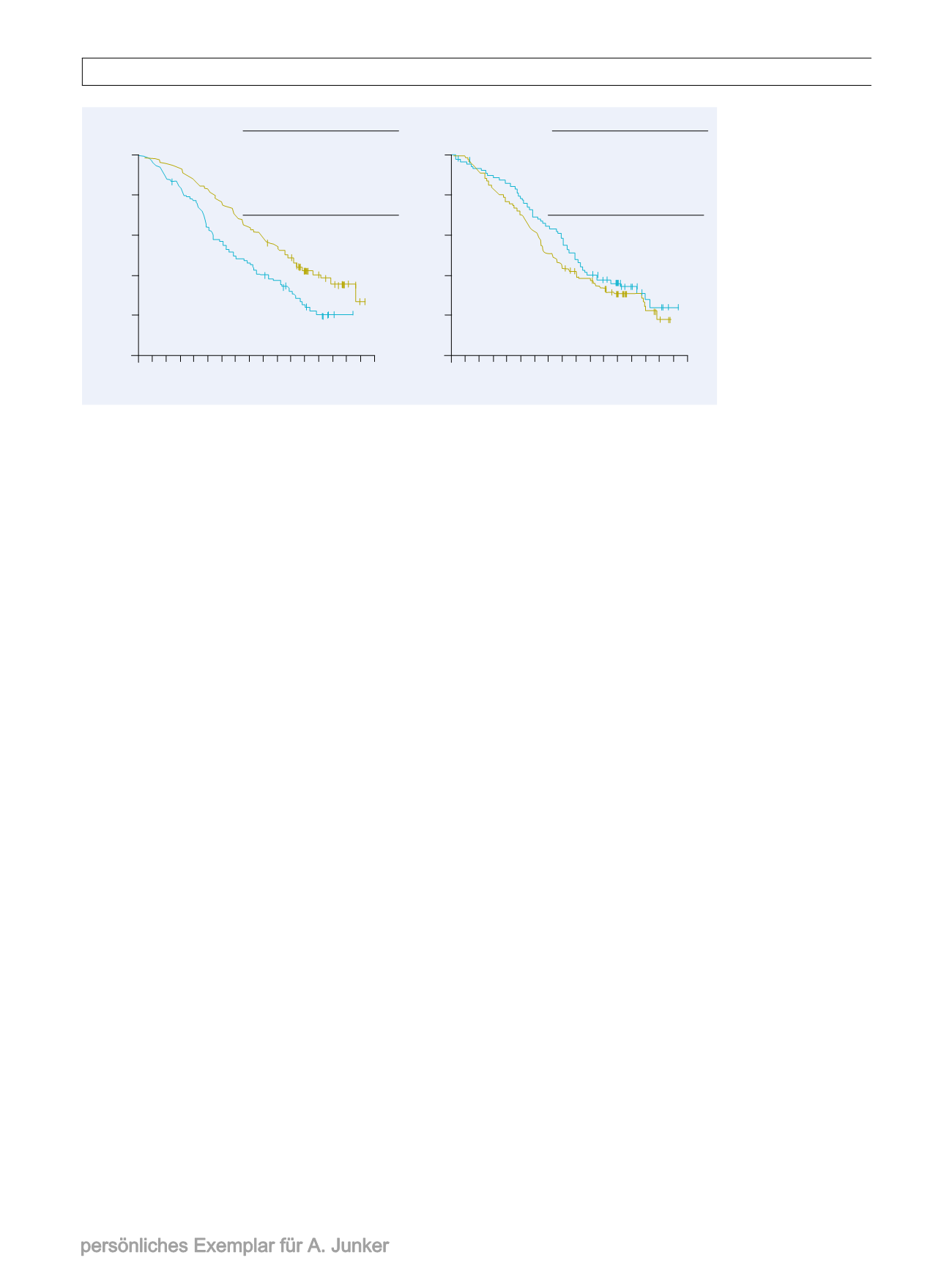
men. Das Gesamtüberleben (OS) wurde
für einzelneMutationen differenziert aus-
gewertet [6]. Während im Gesamtkollek-
tiv das OS für Afatinib median 27,3 und
für Chemotherapie 24,3 Monate betrug
(HR 0,81; CI 0,66–0,99; p=0,037), war der
Unterschied bei del19-Mutation mit 31,7
vs. 20,7 Monate sehr viel deutlicher (HR
0,59; CI 0,45–0,77; p<0,001;
.?
Abb. 2
).
Ungefähr die Hälfte der EGFR-Mutatio-
nen ist eine solche del19-Mutation. Auch
von der Kombination Bevacizumab/Er-
lotinib profitieren diese Patienten beson-
ders, wie eine andere Studie ergab [8]:
Das progressionsfreie Überleben betrug
gegenüber Erlotinib allein insgesamt 16
vs. 9,7 Monate, bei del19-Mutationen 18
vs. 10,3 Monate. Allerdings verursachte
die Kombination deutlich mehr Neben-
wirkungen Grad?3/4 (91 vs. 53%), und
41% der Patienten brachen die Therapie
mit Bevacizumab aus diesem Grund ab.
Der Diskutant der Studie, Howard J. West,
Seattle, gab auch die fast dreifach höhe-
ren Kosten der Kombinationstherapie zu
bedenken (16.700 vs. 6300 $ pro Monat).
MET- und ALK-Inhibition als
therapeutisches Target
Zusätzlich zu EGFR sind auf Bronchial-
karzinomzellen häufig MET-Rezeptoren
überexprimiert, besonders bei erworbe-
nen Resistenzen gegen Tyrosinkinasein-
hibitoren (TKI) und Raucheranamnese.
Eher enttäuschend waren allerdings die
Ergebnisse einer Phase-III-Studie, die den
MET-Antikörper Onartuzumab in Kom-
bination mit Erlotinib gegen Erlotinib al-
lein getestet hat [8]. Weder für das pro-
gressionsfreie noch für das Gesamtüberle-
ben ergab sich ein Vorteil der MET-Inhi-
bition. Günstiger erscheinen erste Ergeb-
nisse des ALK-TKI Crizotinib bei Patien-
ten mit MET-Überexpression. Crizotinib
blockiert sowohl die Kinasen von ALK-
Rezeptoren als auch die von MET und
ROS. Bei fortgeschrittenen MET-NSCLC
sprachen auf Crizotinib die Tumoren mit
intermediärer und hoher MET-Expres-
sion besonders gut an [9].
Ceritinib, ein weiterer ALK-TKI, der
im April von der FDA in einem beschleu-
nigten Zulassungsverfahren zum Ein-
satz nach Crizotinib-Versagen zugelas-
sen wurde, zeigte in dieser Situation noch
eine Antitumoraktivität und hohe Wirk-
samkeit bei Hirnmetastasen [10]. Aller-
dings ist die Toxizität höher als bei Cri-
zotinib. So brachen in dieser Studie 10%
der Patienten die Therapie ab und bei
59% musste die Dosis reduziert werden.
Eine Reduktion der empfohlenen Tages-
dosis von 750 mg sollte daher frühzeitig
in Erwägung gezogen werden, so Disku-
tant Howard West. Weitere Studien sind
erforderlich, um die neuen Substanzen
bestmöglich einsetzen zu können. Auch
der Zeitpunkt ihrer Anwendung sollte neu
überdacht und geprüft werden. Für Cri-
zotinib lieferte die PROFILE-1014-Studie
nun die bisher fehlenden vergleichsge-
stützten Argumente für den Einsatz in der
First-Line-Therapie: Bei akzeptablem Si-
cherheitsprofil verlängerte der ALK-TKI
gegenüber einer Chemotherapie mit Pe-
metrexed und Cis- oder Carboplatin das
progressionsfreie Überleben signifikant
(median 10,9 vs. 7,0 Monate; HR 0,454;
95%-CI 0,346–0,596; p<0,0001; [11]).
0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 51
0 3 6 9 12 15 18 21 24 27 30 33 36 39 42 45 48 51
Zeit (Monate)
1,0
0,8
0,6
0,4
0,2
0
Erhöhte Gesamtüberlebenswahrscheinlichkeit
del(19)
Median
(Monate)
HR (95%-KI),
p-Wert
Afatinib
Chemo
n=236
31,7
0,59 (0,44–0,77),
p=0,0001
20,7
n=119
Zeit (Monate)
1,0
0,8
0,6
0,4
0,2
0
Erhöhte Gesamtüberlebenswahrscheinlichkeit
L858R
Median
(Monate)
HR (95%-KI),
p-Wert
Afatinib
Chemo
n=183
22,1
1,25 (0,92–1,71),
p=0,1600
26,9
n=93
a
b
Abb. 2
9
Kombinier-
te Überlebensanalyse der
Studien LUX-Lung 3 und
LUX-Lung 6.
a
Eine Überle-
bensverlängerung um fast
1?Jahr zeigte sich imVer-
gleich zur Chemotherapie
für Patienten mit DEL19-
Mutationen, die mit Afati-
nib behandelt worden wa-
ren.
b
Solche mit einer Mu-
tation L858R profitier-
ten dagegen imVergleich
zur Chemotherapie nicht.
(Nach [6])
885
Der Onkologe 9 · 2014
|


