le Sicherheit war gegeben. So kam es mit
Pertuzumab in 1,5% zu einer symptomati-
schen linksventrikulären Dysfunktion im
Vergleich zu 1,8% in der Placebo-Gruppe.
Luca Gianni, Mailand, wies in seiner Dis-
kussion der Studie darauf hin, dass bei ER-
positivem Befund keine endokrine The-
rapie erlaubt war und äußerte die Ver-
mutung, dass eine an die Chemoimmun-
therapie anschließende endokrine Thera-
pie den Überlebensvorteil der doppelten
HER2-Inhibition möglicherweise weiter
steigern könnte.
Kopf-Hals-Tumoren
Längeres PFS und bessere
Krankheitskontrolle mit Afatinib
Patienten mit rezidivierten oder metas-
tasierten Plattenepithelkarzinomen im
Kopf-Hals-Bereich (HNSCC) haben
nach platinbasierter Chemotherapie kei-
ne günstige Perspektive; eine erfolgver-
sprechende Zweitlinientherapie ist nicht
definiert. Afatinib als irreversibler ErbB-
Inhibitor hat in einer Phase-II-Studie bei
dieser Entität Aktivität gezeigt. Dies war
die Rationale für die Phase?III Studie Lux-
Head & Neck. Hier wurden 483 Patien-
ten mit Rezidiv nach platinhaltiger Che-
motherapie für Afatinib oral oder Me-
thotrexat (MTX) i.v. randomisiert [4].
Afatinib verlängerte gegenüber MTX si-
gnifikant das mediane progressionsfreie
Überleben [2,6 vs. 1,7 Monate, HR=0,80
(CI 0,65–0,98); p=0,03]. Auch die Krank-
heitskontrollrate war im Afatinib-Arm
besser (49,1% vs. 38,5%; p=0,04). Gegen-
über MTX verzögerte Afatinib außer-
dem das Auftreten von Beschwerden wie
Schmerzen oder Schluckstörungen (bei-
de p=0,03). Unter Afatinib waren weni-
ger Dosisreduktionen erforderlich, und
auch weniger schwerwiegende Zwischen-
fälle traten auf. Die häufigsten Grad-
3/4-Nebenwirkungen waren im Afati-
nib-Arm Rash/Akne (9,7%) und Diar-
rhö (9,4%), im MTX-Arm Leukopenie
(15,6%) und Stomatitis (8,1%). Das me-
diane Gesamtüberleben unterschied sich
nicht signifikant zwischen den Gruppen
[6,8 vs. 6,2 Monate; HR=0,94 (0,75–1,18)].
Dies könnte u.?a. durch die unterschied-
lichen Folgetherapien in den beiden Ar-
men bedingt sein, vermuteten die Auto-
ren. So bekamen z. B. signifikant mehr Pa-
tienten imMTX-Arm anschließend noch
Anti-EGFR-Therapien. Weitere Studien
sollten nun untersuchen, welche Patien-
ten besonders von der TKI-Therapie pro-
fitieren können.
Maligne Melanome
Neue Daten zu
Checkpoint-Inhibitoren
Ein Presidential Symposium hatte die
Therapie fortgeschrittener Melanome
zum Thema. Mit dem Antikörper Ni-
volumab wurde ein Verteter der neuen
Wirkstoffklasse der sog. Checkpoint-In-
hibitoren vorgestellt. Nivolumab blockiert
das Protein PD-1 („programmed cell de-
ath 1“), das auf der Oberfläche von akti-
vierten T-Zellen zu finden ist. Über PD1
kann durch bestimmte Liganden die Im-
munanwort herunterreguliert werden.
Viele Krebszellen produzieren PD-1-Li-
ganden, die über PD1 die Aktivierung
von T-Zellen und damit eine Antitumor-
reaktion unterdrücken. Hier greifen die
Checkpoint-Inhibitoren ein, indem sie
PD1 neutralisieren und die Bremse der
Immunantwort lösen. In frühen Studien
konnte bereits gezeigt werden, dass dies
bei akzeptabler Toxizität zu einer Ver-
kleinerung des Tumors führt. Eine Phase-
III-Studie verglich bei 405 Patienten mit
nicht resektablen metastasierten Melano-
men und Progress unter Ipilimumab den
Checkpoint-Inhibitor Nivolumumab mit
einer Chemotherapie nach Wahl des be-
handelndenArztes (Dacarbazin oder Car-
boplatin plus Paclitaxel). Nach einer ers-
ten Ergebnisanalyse war die Ansprechrate
unter Nivolumuab deutlich höher als mit
Chemotherapie (32% vs. 11%), und die Re-
sponse hielt länger an. In der Chemothe-
rapie-Gruppe kam es bei 31% der Patien-
ten zu schwerenNebenwirkungen imVer-
glich zu 9% im Nivolumab-Arm [5].
Vorteil für primäre Kombinations-
therapie bei BRAF-V600-Mutation
Bei Melanomen mit BRAF-V600-Mu-
tation spricht einiges für den primären
Einsatz von Kombinationstherapien mit
BRAF- und MEK-Inhibitoren. Letztere
greifen wie BRAF-Inhibitoren in den bei
Melanomen mit BRAF-Mutation kons-
titutionell aktivierten MAPK-Signal-
weg ein, aber an einer anderen Stelle. Die
Kombination kann Studien zufolge so-
wohl die Resistenzentwicklung wie auch
das Auftreten kutaner Nebenwirkungen
bremsen. In einer zweiarmigen Studie er-
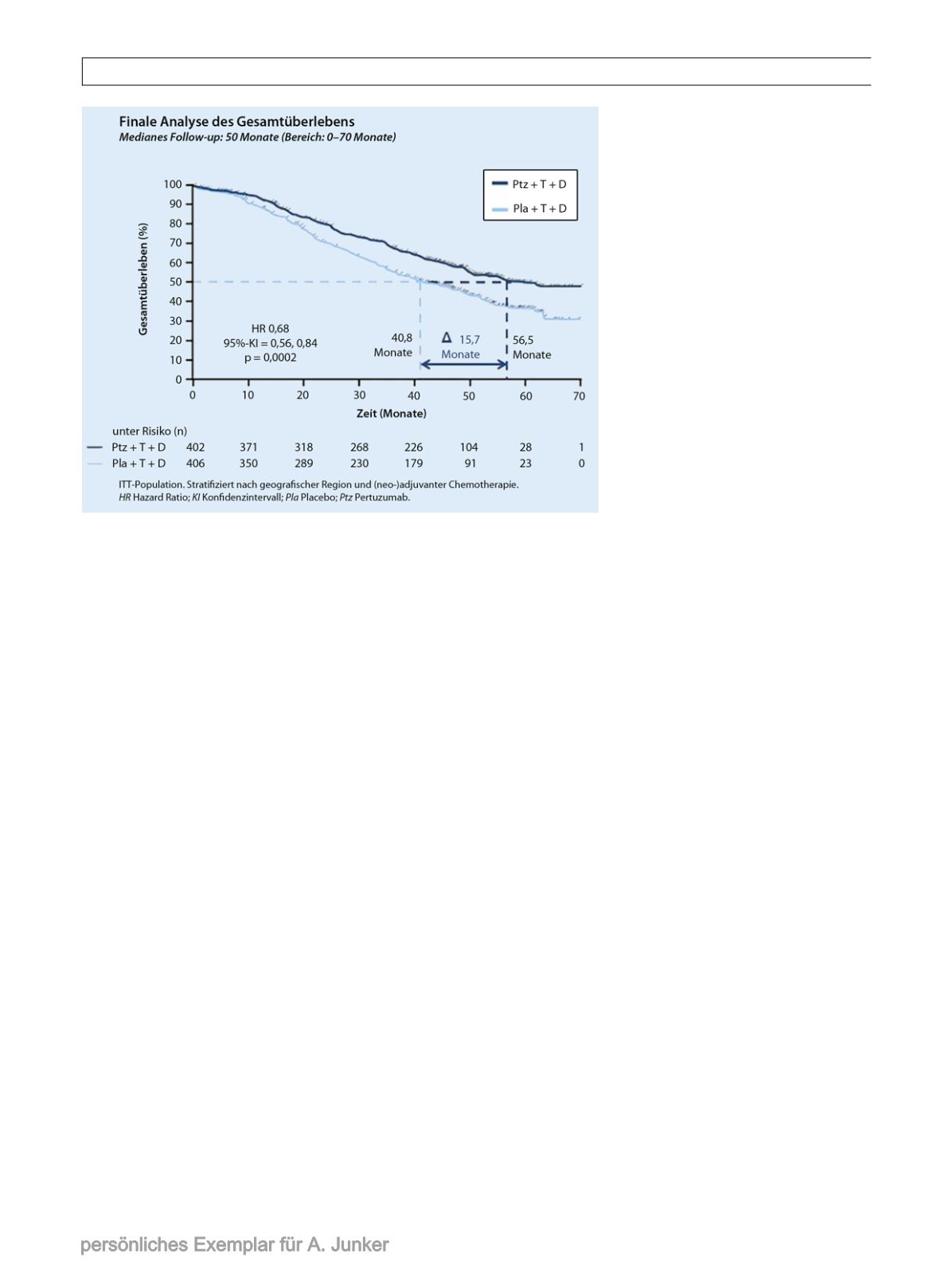
Abb. 1
8
Das mediane Gesamtüberleben für die Patientinnen mit der doppelten HER2-Blockade war
15,7 Monate länger. (Nach [3])
165
Der Onkologe 2 · 2015
|


